may 16, 2023
Philips proporciona información actualizada sobre el conjunto completo de resultados de las pruebas para dispositivos de terapia del sueño CPAP/BiPAP
Amsterdam, Países Bajos – Royal Philips (NYSE: PHG, AEX: PHIA), brinda hoy una actualización sobre el programa integral de prueba e investigación de su subsidiaria Philips Respironics para evaluar los posibles riesgos para la salud relacionados con la espuma de reducción de sonido de poliuretano a base de poliéster (PE-PUR) en dispositivos específicos de terapia del sueño y ventiladores bajo la Notificación voluntaria de retiro y aviso de seguridad de campo de junio, 2021. *
Ya se han completado las evaluaciones de riesgo para los dispositivos de terapia del sueño CPAP/BiPAP bajo la notificación de retiro/aviso de seguridad de campo*, es decir, los dispositivos DreamStation, System One y DreamStation Go de primera generación, que representan aproximadamente el 95 % de los dispositivos registrados a nivel mundial. Las evaluaciones se basan en las actualizaciones anteriores en diciembre de 2021, junio de 2022 y diciembre de 2022. Además, se han completado pruebas y análisis para dispositivos DreamStation de primera generación que han estado expuestos a la limpieza con ozono.
Métodos de prueba
El programa de prueba e investigación se ha llevado a cabo junto con cinco laboratorios de prueba certificados e independientes, y los resultados han sido revisados y evaluados por expertos calificados externos y Philips Respironics, así como también por un panel médico externo.
Los métodos de prueba aplicados, que comprenden planificación de pruebas, ejecución de pruebas e interpretación de los resultados para las evaluaciones de riesgos completadas, están de acuerdo con las normas aplicables de la industria ISO 18562 [1,2] e ISO 10993 [3]. El diseño de los métodos de prueba aplicados se basó científicamente en una consideración exhaustiva y la mitigación de las limitaciones inherentes a las pruebas. Por ejemplo, se realizaron pruebas en múltiples dispositivos usados con diferentes cantidades de uso por parte del paciente y se observó degradación visual de la espuma, y en espuma envejecida en laboratorio que se había degradado intencionalmente en diferentes grados. En las evaluaciones del riesgo se incluyeron supuestos muy conservadores. Más ejemplos se proporcionan al final de este comunicado de prensa.
"Nuestra primera prioridad es la salud y el bienestar de los pacientes", mencionó Roy Jakobs, CEO de Royal Philips. “Por lo tanto, nos hemos centrado en el programa integral de pruebas e investigación para obtener más claridad sobre la seguridad de los dispositivos afectados y en proporcionar dispositivos de reemplazo a los pacientes. Las evaluaciones de riesgo de terceros para los dispositivos de terapia del sueño presentadas hoy son positivas y tranquilizadoras, además estamos haciendo un buen progreso con la remediación de los dispositivos afectados. Las autoridades competentes pertinentes a nivel mundial, incluida la FDA, todavía están revisando los resultados de las pruebas y las evaluaciones. Compartimos el mismo objetivo de garantizar la seguridad del paciente y la calidad en la prestación de atención médica, y seguimos comprometidos para trabajar en estrecha colaboración con estas agencias. La finalización de las pruebas y la remediación de los dispositivos afectados siguen siendo nuestras principales prioridades".
Resultados de pruebas y análisis para dispositivos de terapia del sueño no expuestos a la limpieza con ozono
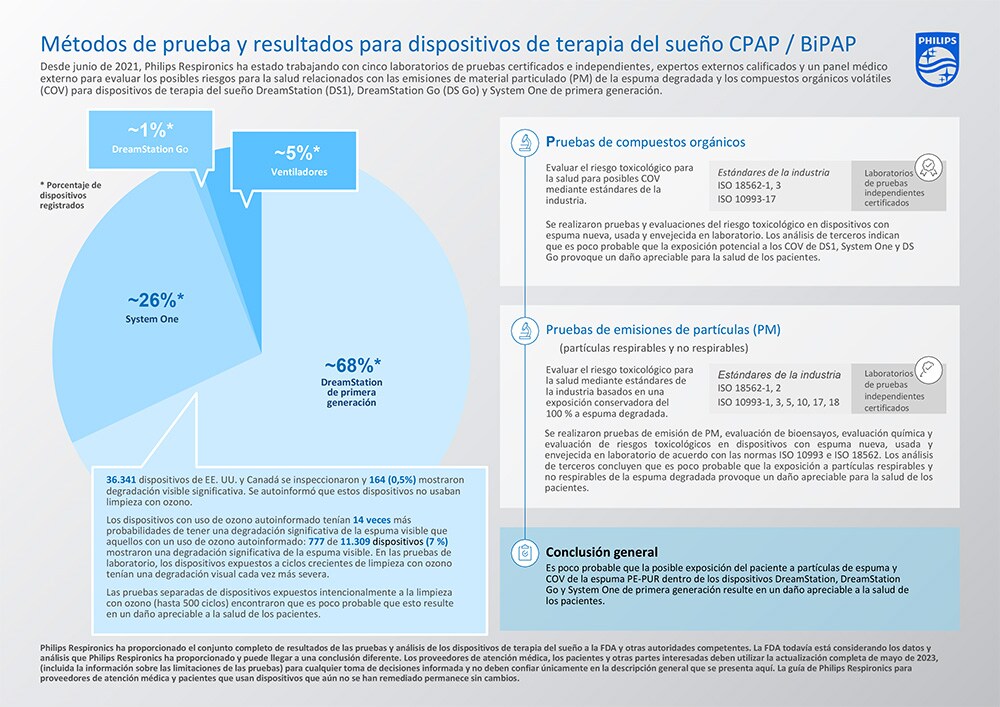
El conjunto completo de resultados de pruebas y análisis para los dispositivos de terapia del sueño DreamStation, System One y DreamStation Go de primera generación indican que es poco probable que la exposición potencial del paciente a partículas en espuma (PM) y compuestos orgánicos volátiles (COV) de la espuma PE-PUR dentro de estos dispositivos resulte en un daño apreciable a la salud de los pacientes. Las pruebas y conclusiones realizadas se han resumido en la tabla a continuación.
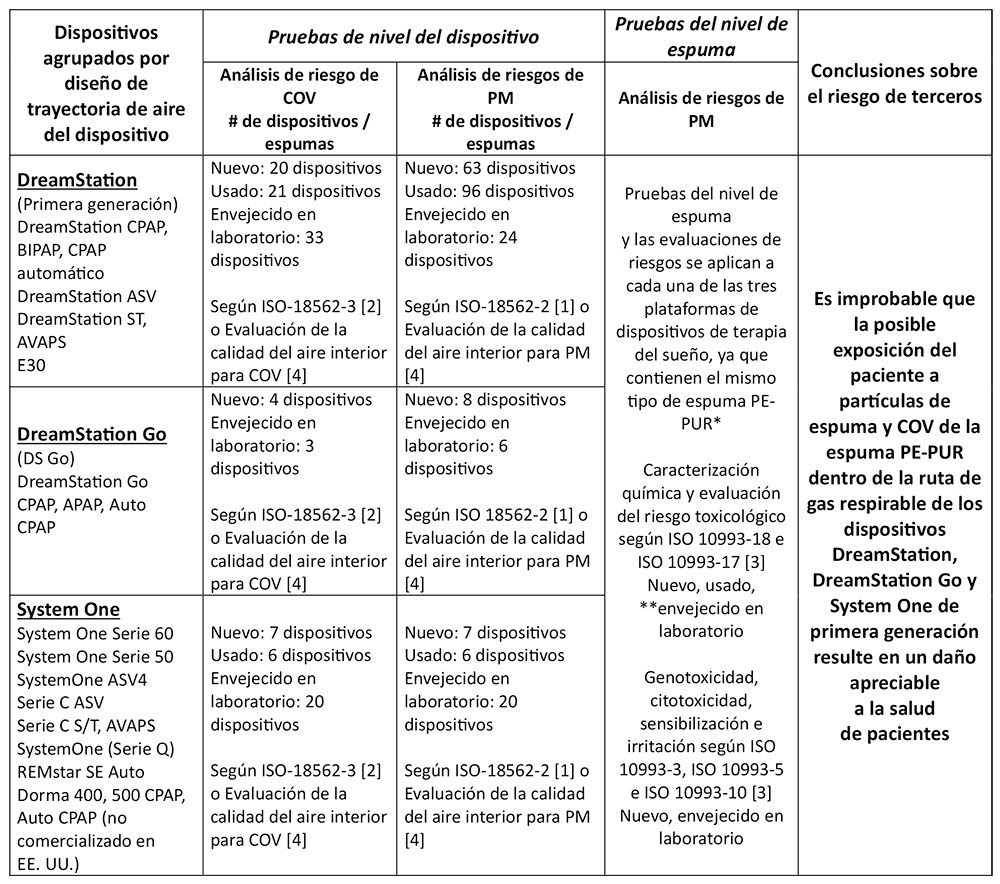
COV: Compuestos orgánicos volátiles (COV) PM: Material particulado * La cantidad total de espuma en los dispositivos varía de aproximadamente 1 g a 10 g, en función del diseño y la configuración de la trayectoria aérea del dispositivo. Los dispositivos dentro de cada plataforma comparten el mismo diseño y configuración de la trayectoria aérea, incluida la cantidad de espuma presente. ** La espuma de 7 dispositivos DreamStation usados de primera generación diferentes se caracterizó químicamente según ISO 10993-18 y -17 [3] e incluyó espuma representativa de una gama de estados de degradación visual.
Las pruebas ampliadas y las evaluaciones de riesgos toxicológicos en múltiples dispositivos con espuma nueva, usada y envejecida en laboratorio no han demostrado ningún daño apreciable a la salud para los COV detectados según las pruebas ISO 18562-3 [2], y una evaluación de riesgos de terceros concluyó que es poco probable que la exposición a COV para estos dispositivos resulte en un daño apreciable a la salud de los pacientes.
Se probaron dispositivos nuevos, envejecidos en laboratorio y usados, y todos cumplieron con los límites permitidos de emisiones de PM de la norma ISO 18562-2 [1]. Las pruebas se realizaron en dispositivos usados (es decir, dispositivos utilizados anteriormente por pacientes) con diversos grados de degradación (es decir, desde ninguna degradación visible hasta degradación visible severa), dispositivos nuevos y dispositivos con espuma envejecida en laboratorio que intencionalmente habían sido expuestos a temperaturas significativamente elevadas (≥80 °C) y humedad (≥75 % HR) para acelerar la degradación.
Además, las emisiones de PM probadas de dispositivos usados con degradación visible no fueron estadísticamente diferentes de las emisiones de PM de dispositivos usados sin degradación, lo que sugiere que la degradación no contribuyó a niveles elevados apreciables de partículas respirables en los dispositivos probados.
Incluso con la suposición teórica y muy conservadora de que toda la espuma podría degradarse y que un paciente queda expuesto a toda la espuma PE-PUR degradada dentro de los dispositivos, la evaluación de riesgos de terceros concluyó que la exposición a partículas de espuma degradada en estos dispositivos, incluidas las posibles partículas respirables y no respirables, es poco probable que provoquen un daño apreciable para la salud de los pacientes.
Con base en la inspección visual de la espuma en los dispositivos DreamStation de primera generación devueltos, se encontró que la prevalencia de degradación visible de la espuma era baja. La inspección visual solo puede identificar la degradación visible de la espuma y no puede medir la generación de compuestos orgánicos volátiles ni cuantificar la pérdida de partículas. Por lo tanto, se realizaron pruebas y análisis adicionales como se describe anteriormente y en la actualización completa.
El impacto de la limpieza con ozono en la degradación de la espuma en los dispositivos DreamStation de primera generación
Philips Respironics ha completado las pruebas en dispositivos DreamStation de primera generación que han estado expuestos a la limpieza con ozono:
Las pruebas de COV ISO 18562-3 mostraron que después de 200 ciclos de limpieza con ozono (cada ciclo simulaba una noche de uso y luego limpieza con ozono), el dietilenglicol (DEG) se volvió detectable como COV. Las pruebas se realizaron hasta 500 ciclos de limpieza con ozono, y un riesgo toxicológico de COV de esta degradación inducida por el ozono determinó que la exposición a las emisiones de COV de los dispositivos DreamStation de primera generación evaluados expuestos a la limpieza con ozono no sugiere un riesgo apreciable para la salud de los pacientes.
En cuanto a los riesgos asociados con partículas respirables y no respirables, hasta la fecha se han realizado pruebas en dispositivos con exposición conocida al ozono. Por ejemplo, dos dispositivos DreamStation de primera generación usados con exposición al ozono informada por el usuario se incluyeron en las pruebas de extraíbles y lixiviables, que formaron la base para una evaluación de riesgos toxicológicos del dispositivo de terapia del sueño con partículas de espuma PE-PUR. Ese análisis colectivo de terceros concluyó que es poco probable que la exposición a partículas de espuma degradada en los dispositivos DreamStation de primera generación provoque un daño apreciable para la salud de los pacientes.
Como se publicó anteriormente, los datos de la DreamStation de primera generación indican que los dispositivos con limpieza con ozono informada por el usuario tienen 14 veces más probabilidades de tener una reducción de volumen/degradación de espuma visible significativa en comparación con los dispositivos sin exposición al ozono informada por el usuario. Esta observación es consistente con las pruebas de laboratorio, donde los dispositivos DreamStation de primera generación expuestos a ciclos crecientes de limpieza con ozono tenían una degradación visual cada vez más severa. Sin embargo, como se concluyó anteriormente, es poco probable que esto resulte en un daño apreciable a la salud de los pacientes.
Resumen de las pruebas en curso
Philips Respironics está en proceso de completar varias pruebas y análisis restantes. Se están completando las evaluaciones de riesgos para los dispositivos System One y DreamStation Go (que contienen la misma espuma que los dispositivos DreamStation de primera generación) tratados con limpieza con ozono. Para los dispositivos de ventilación Trilogy 100/200 y OmniLab Advanced Plus, continúan las pruebas de COV y PM, así como la evaluación química y la evaluación de riesgos toxicológicos. Estos dispositivos contienen un tipo diferente de espuma PE-PUR que los dispositivos DreamStation de primera generación [5]. Philips Respironics espera proporcionar una actualización sobre esto durante el tercer trimestre de 2023.
Orientación para proveedores de atención médica y pacientes
Se solicita a los pacientes que actualmente usan dispositivos de terapia del sueño afectado que aún no se han remediado y registrado, que registren sus dispositivos para facilitar la remediación.
Philips Respironics continúa recomendando a los pacientes que usan dispositivos de terapia del sueño afectados que aún no se han remediado que se comuniquen con su médico o proveedor de atención para decidir un tratamiento adecuado para su condición, que puede incluir dejar de usar su dispositivo, continuar usando su dispositivo afectado, usar otro dispositivo similar que no sea parte del retiro del mercado o usar tratamientos alternativos para la apnea del sueño. Además, se recomienda a los pacientes que sigan las instrucciones de Philips Respironics y las pautas de limpieza y reemplazo recomendadas para su dispositivo de terapia del sueño y sus accesorios. Los productos de limpieza con ozono y luz ultravioleta no son métodos de limpieza aprobados actualmente para dispositivos o mascarillas de terapia del sueño y no deben usarse.
Philips Respironics también sigue recomendando a los usuarios de dispositivos de ventiladores que se comuniquen con sus proveedores de atención médica antes de realizar cambios en su terapia.
Fundamentos científicos de los métodos de ensayo
El diseño de los métodos de prueba aplicados se basó científicamente en una consideración exhaustiva y la mitigación de las limitaciones de prueba que son inherentes a cualquier estándar de prueba o investigación científica. Para ilustrar esto, se enumeran a continuación ejemplos de tales consideraciones y mitigaciones.
La base científica de los métodos de prueba aplicados incluyó una consideración y mitigación exhaustivas de las limitaciones de las pruebas, por ejemplo:
Notas [1] ISO 18562-2: Evaluación de biocompatibilidad de vías de gases respiratorios en aplicaciones sanitarias – Parte 2: Ensayos de emisiones de partículas. [2] ISO 18562-3: Evaluación de la biocompatibilidad de las vías del gas respirable en aplicaciones sanitarias - Parte 3: Ensayos de emisiones de compuestos orgánicos volátiles. [3] ISO 10993: Evaluación biológica de dispositivos médicos; Parte 1: Evaluación y pruebas dentro de un proceso de gestión de riesgos; Parte 3: Ensayos de genotoxicidad, carcinogenicidad y toxicidad para la reproducción, Parte 5: Pruebas de citotoxicidad in vitro; Parte 10: Pruebas de irritación y sensibilización de la piel; Parte 17: Establecimiento de límites permisibles para sustancias lixiviables; Parte 18: Caracterización química de materiales de dispositivos médicos dentro de un proceso de gestión de riesgos. [4] La norma que se utilizó para las pruebas anteriores a ISO 18562. [5] Los dispositivos DreamStation, System One y DreamStation Go de primera generación contienen espuma PE-PUR Tipo A, mientras que los dispositivos Trilogy 100/200 contienen espuma PE-PUR Tipo B, y los dispositivos OmniLab Advanced Plus contienen espumas Pe-PUR Tipo A y Tipo B. Las diferencias conocidas entre las espumas Tipo A y Tipo B son que la espuma Tipo B se puede usar con un adhesivo acrílico sensible a la presión, tiene una densidad más baja, tiene un grosor diferente y también contiene un aditivo para reducir la inflamabilidad potencial.
* Notificación de retiro voluntario en Estados Unidos / Aviso de seguridad de campo para el resto del mundo.
Acerca de Royal Philips
Royal Philips (NYSE: PHG, AEX: PHIA) es una empresa líder en tecnología de la salud centrada en mejorar la salud y el bienestar de las personas a través de una innovación significativa. La innovación centrada en el paciente y las personas de Philips aprovecha la tecnología avanzada y los profundos conocimientos clínicos y del consumidor para ofrecer soluciones de salud personal para los consumidores y soluciones de salud profesional para los proveedores de atención médica y sus pacientes en el hospital y el hogar. Con sede en los Países Bajos, la empresa es líder en diagnóstico por imágenes, ultrasonido, terapia guiada por imágenes, monitorización e informática empresarial, así como también en salud personal. Philips generó unas ventas en 2022 de 17.800 millones de euros y da empleo a unos 74.000 trabajadores con ventas y servicios en más de 100 países. Para acceder a las noticias de Philips, siga este enlace:www.philips.com/newscenter.
Declaraciones de proyecciones a futuro
Este comunicado contiene declaraciones de proyecciones a futuro con respecto a las condiciones financieras, los resultados de las operaciones y los negocios de Philips, y ciertos planes y objetivos de Philips con respecto a estos temas. Entre los ejemplos de declaraciones de proyecciones a futuro podemos mencionar declaraciones hechas con respecto a la estrategia, estimaciones del crecimiento de las ventas, EBITDA futuro, desarrollos futuros en negocios orgánicos de Philips y la conclusión de adquisiciones y desinversiones. Por su naturaleza, estas declaraciones implican riesgos e incertidumbre, ya que hacen referencia a circunstancias y acontecimientos futuros, y hay varios factores que podrían dar lugar a resultados y acontecimientos que sean sustancialmente diferentes de aquellos que han sido expresados o insinuados en estas declaraciones.
Temas
Contactos

Steve Klink
Philips Global Press Office Tel: +31 6 10888824
You are about to visit a Philips global content page
Continue
Elco van Groningen
Philips Global Press Office Tel: +31 6 8103 9584
You are about to visit a Philips global content page
ContinueMaterial gráfico